
در مقاله قبل به تعریف آب سخت، منابع سختی آب، سختی موقت آب و سختی دائم آب پرداختیم. در ادامه مقاله قصد داریم به مشکلاتی که در اثر سختی آب به وجود می آید صحبت کنیم. برای مطالعه مقاله قبل می توانید روی لینک آب سخت چیست کلیک نمایید.
محلول صابون در آب سخت، بجای تولید کف، تشکیل رسوب سفید (تفاله صابون) میدهد، زیرا یون های 2+ با تشکیل یک رسوب جامد (ذرات صابون) خواص سورفاکتانت صابون را از بین می برند. جزء اصلی این کف از استیرات کلسیم، مولفه اصلی صابون، بوجود میآید:
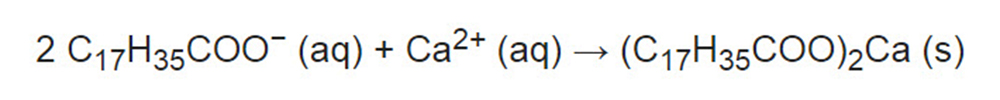
بنابراین سختی آب را میتوان به صورت ظرفیت مصرف صابون در یک نمونه آب، یا ظرفیت رسوب صابون، بصورت یک ویژگی آب که مانع از کف کردن صابون میشود، تعریف کرد. شویندههای مصنوعی چنین تفالههایی را تشکیل نمیدهند. تصویر زیر بخشی از قنات ایفل رومی باستان در آلمان است. حدود 180 سال پیش از آن استفاده میشده، روی دیوارههای این قنات رسوباتی به ضخامت 20 سانتی متر تشکیل شده است.

آب سخت رسوباتی را تشکیل میدهد که باعث گرفتگی لوله ها میشود. این رسوبات که «پوسته» نام دارند اصولا از کربنات کلسیم (CaCO3)، هیدروکسید منیزیم (Mg(OH)2)، و سولفات کلسیم (CaSO4) تشکیل شدهاند. کربنات کلسیم و منیزیم معمولا به صورت جامدات سفید درون سطوح لولهها و وسایل گرمایشی رسوب میکند. این رسوب (تشکیل یک جامد نامحلول) عمدتا ناشی از تجزیه حرارتی یونهای بیکربنات است اما در مواردی که یون کربنات در غلظت اشباع است هم اتفاق می افتد.
تشکیل پوسته حاصل، باعث محدود شدن جریان آب در لولهها میشود و در دیگ های بخار، رسوبات باعث آسیب به جریان گرما در آب شده، بازدهی گرمایش را کاهش داده و باعث میشود قطعات فلزی دیگ های بخار بیش از حد گرم شوند. در سیستم تحت فشار، این گرمایش بیش از حد میتواند منجر به خرابی دیگ های بخار شود. صدمه ناشی از رسوب کربنات کلسیم بر اساس شکل کریستال ، به عنوان مثال کالسیت یا آراگونیت متفاوت است. حضور یون ها در یک الکترولیت، در این مورد، آب سخت می تواند باعث خوردگی گالوانیک شود، که در آن یک فلز ترجیحا در صورت تماس با نوع دیگری از فلز، هنگامی که هر دو در تماس با یک الکترولیت می باشند، زنگ میزند.
نرم کردن آب سخت بوسیله تبادل یون باعث افزایش خوردگی آن نمیشود. بطور مشابه، جایی که از لولهکشی سرب استفاده میشود، آب نرم شده باعث افزایش اساسی قابلیت حل شدن سرب نمیشود. در استخرها، آب سخت بوسیله ظاهر کدر یا تیره آب مشخص میشود. هیدروکسید کلسیم و منیزیم هر دو در آب قابل حل هستند. انحلالپذیری هیدروکسیدهای فلزات قلیایی زمین که کلسیم و منیزیم جزو آنها هستند (گروه 2 جدول تناوبی) باعث افزایش پایین رفتن از ستون میشوند.
محلولهای آبی این هیدروکسیدهای فلزی دی اکسید کربن را از هوا جذب می کنند، کربناتهای نامحلول را تشکیل می دهند و کدری را افزایش میدهند. این مساله اغلب ناشی از بالا بودن pH است(pH > 7.6). بنابراین، یک راه حل معمول برای حل این مشکل این است که با حفظ غلظت کلر در سطح مناسب، pH را با افزودن اسید هیدروکلریک پایین بیاوریم، که ارزش مطلوب آن در محدوده 7.2 تا 7.6 است.
سختیگیری آب
سختیگیری آب اغلب مطلوب است. بیشتر شویندهها حاوی عناصری هستند که اثرات آب سخت بر روی سورفکتانت ها (مواد فعال) را خنثی میکنند. به همین دلیل، سختیگیری آب اغلب غیرضروری است. جایی که سختیگیری آب انجام میشود، اغلب پیشنهاد میشود که تنها آب ورودی به سیستم آب داغ خانگی سختیگیری شود تا مانع از ناکارآمدی و صدمه، به علت شکلگیری پوسته در هیترهای آب شود یا این فرایند به تاخیر بیافتد.
یک روش معمول برای سختیگیری آب شامل استفاده از رزینهای تبادل یون است که یونهایی مثل Ca2+ را با دو برابر تعداد کاتیونهایی مثل یونهای سدیم و پتاسیم جایگزین میکند. شستشوی قلیایی (کربنات سدیم، Na2CO3) به آسانی بدست آمده و مدت طولانی به عنوان سختیگیر آب برای لباسشویی خانگی، همراه با صابون یا شوینده استفاده شده است.
در مقاله بعد به اندازه گیری میزان سختی آب می پردازیم. برای مطالعه ادامه مقاله می توانید روی لینک کلیک نمایید.
برای مطالعه مقاله مقایسه آب سخت و آب نرم روی لینک کلیک نمایید.
برای مطالعه مقاله میزان سختی آب در کشورهای مختلف روی لینک کلیک نمایید.
**ن

