
خاک می تواند به یون های مثبت (مانند K+ وCa2+ ) بپیوندد، زیرا حاوی کانی های خاک رس و هومیک اسیدهای آلی است. هر دوی این مواد نامحلول هستند که به عنوان بخشی از چارچوب مولکولی شان، حامل گروه های یونی با بار منفی می باشند. به عنوان مثال، در خاک رس، این گروه ها، قسمت پایانی زنجیره های سیلیکون-اکسیژن یا اتم های اکسیژن را تشکیل می دهند که حامل یک الکترون اضافی است؛ زیرا آنها به جای دو اتم معمول، تنها به یک اتم متصل هستند، و اتم های آلومینیوم نیز به جای سه اکسیژن، با چهار اکسیژن متصل هستند. تصاویر شماتیک زیر هر دو نوع ساختار یونی را نشان می دهد که در تنوع تقریبا بی نهایتی از سیلیکات ها و آلومینوسیلیکات های طبیعی و مصنوعی موجود است.
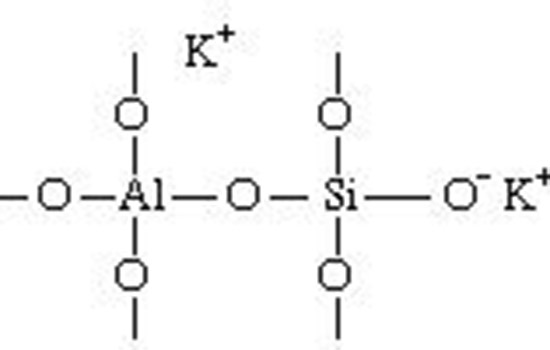
یون های منفی بخشی از چارچوب هستند؛ و یونهای مثبت، در اینجا به صورت پتاسیم نشان داده شده اند، کوچک هستند و اگر این ماده ی جامد با یک محلول تماس پیدا کند، می توانند جایشان را با یون های مثبت عوض کنند. یونهای مثبت کوچک باید بتوانند به داخل و خارج حرکت کنند. اما باید بر روی سطوح و یا در شکاف های ریز ساختار مشبّک باز قرار بگیرند.
دو شرط لازم برای تبادل یونی - بارهای یونی ثابت در مواد موجود و نفوذ پذیری مواد نسبت به یک محلول- در تعداد بسیار زیادی از مواد وجود دارد. بارهای ثابت ممکن است مانند مثال بالا منفی بوده، یا اینکه مثبت باشند. بار یون های متحرک باید مخالف بار یون های ثابت باشد. موادی که بار ثابت منفی دارند (مانند شکل 1) یون های مثبت یا کاتیون ها را مبادله می کنند و این فرایند تبادل کاتیون نام دارد. آن هایی هم که به بارهای مثبت ثابت دارند بارهای منفی یا آنیون ها را مبادله می کنند و گفته می شود که دستخوش تبادل آنیون می شوند.
در سال 1935، که نخستین رزین های تبادل یونی توسط شیمی دانان انگلیسی، باسیل آلبرت آدامز و اریک لیتون هولمز کشف شد، پیشرفت بزرگی در فن آوری تبادل یون صورت گرفت. رزین ها، بستگان شیمیایی پلاستیک باکالیت بودند و از طریق تغلیظ پلی هیدریک فنول ها یا اسیدهای فنول سولفونیک با فرمالدئید ساخته شدند.
در سال 1944 گائتانو افدالیلیو ثبت پلیمرهای استایرن-دیوینیل بنزن را اختراع کرد که موادی با مولکول های شبکه مانند بزرگی هستند، که گروه های یونی توسط معادلات شیمیایی در آن ها گنجانده می شد. ساختار این ترکیبات ممکن است به این شکل باشد:
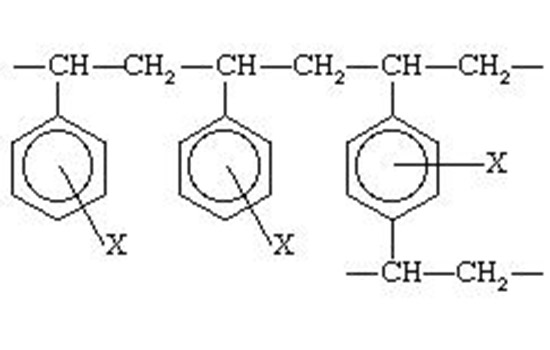
که در آن X نشان دهنده ی گروه های یونی است، که ممکن است در مکان های مختلفی در حلقه های بنزن وجود داشته باشند. در فرمولی که نشان داده شد، دو حلقه ی اول بنزن از استایرن آمده، در حالی که سومین حلقه از دیوینیل بنزن حاصل شده است. بنابراین دیوینیل بنزن، رابطه ی متقابلی بین زنجیره های پلی استایرن ایجاد می کند، که آن ها را به یک شبکه ی سه بعدی پیوند می زند که بسته به نسبت دیوینیل بنزن به استایرن، می تواند تنگ یا گشاد شود. این نسبت را می توان به صورت ارادی تغییر داد؛ نسبت تجارتی معمولی 8 درصد است.
گروه های یونی ممکن است از گروه های سولفونیک اسید، یعنی −SO3−H+ یا گروه های آمونیوم چهارتایی یعنی −CH2N+(CH3)3Cl− باشند. این دو نوع پاسخگوی حدود 90 درصد از رزین های تبادل یونی تولید شده هستند. یون های هیدروژن و یون های کلرید ممکن است توسط یون های دیگر، مانند Na+ (سدیم) یا OH− (هیدروکسید) جایگزین شوند؛ اشکال هیدروژن و هیدروکسید این رزین ها، به ترتیب، اسیدها و بازهایی بسیار قوی هستند.
استایرن و دیوینیل بنزن، مایعات هستند و به صورت قطرات کروی پلیمریزه شده اند، و در نتیجه رزین ها به شکل دانه هایی هستند که حوزه هایی تقریبا کامل می باشند. این دانه ها زمانی که در آب قرار می گیرند متورم می شوند، و گرچه صاف و نفوذ ناپذیر به نظر می رسند، در واقع در مقابل آب و یون های کوچک بسیار نفوذپذیر هستند. قطر هایشان ممکن است از چند میکرون (یک هزارم میلی متر) تا یک تا دو میلی متر متفاوت باشد. اندازه های مختلف برای مقاصد مختلف به کار می روند.
گروه های یونی غیر از اسید سولفونیک و نمک آمونیوم چهارتایی ممکن است در ساختار رزین گنجانده شود. یکی نمونه ی مفید، آمینو دی استات −CH2N(CH2COOH)2 است، که که با تمام فلزات به جز فلزات قلیایی، ترکیبات کیلاتی (ساختارهایی که توسط پیوند های ثانویه به هم چسبیده می شوند) را تشکیل می دهد. ثبات این ترکیبات از فلز به فلز بسیار متفاوت است. رزین های کیلیت ساز در تجزیه ی شیمیایی، برای جداسازی و تغلیظ فلزات کمیاب مورد استفاده قرار می گیرند.
رزین های حاوی گروه کربوکسیل، -COOH، که در پزشکی و بیوشیمی استفاده می شوند، نه بر پایه ی پلی استایرن، بلکه بر پایه ی اسید پلی متاکریلیک هستند:
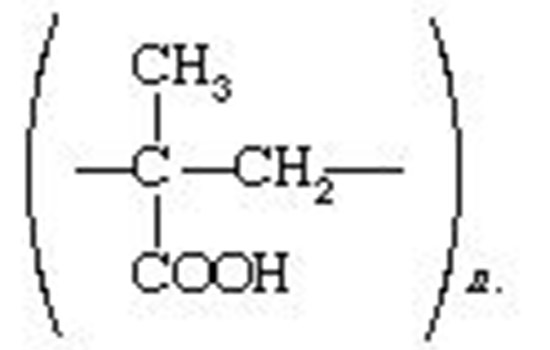
هنوز هم نوع دیگری از مبدّل های یون، با قرار دادن گروه های مختلف یونی در مولکول های سلولز ساخته شده است. از آنجا که یون ها به جای بودن در داخل چارچوب مولکولی، بر روی سطح مولکول های نخ مانند قرار دارند، در دسترس یون ها و مولکول های بزرگ هستند. مبدّل های مبتنی بر سلولز، به ویژه در بیوشیمی مفید هستند.
مبدل های مصنوعی غیر آلی از سال 1903 شناخته شده اند. آلومینو سیلیکات ها اولین نوع آن ها بودند. حدود سال 1955 مشخص شد که فسفات ها، أرسنات ها، و مولیبدات های تیتانیوم، زیرکونیم و توریم مبدّل های کاتیون خوبی هستند. و بسیاری از این مواد تا حدودی به صورت تجاری فراهم شده اند. آنها در صنعت برق هسته ای مفید هستند زیرا در برابر تشعشعات، مقاوم بوده و در مقابل برخی از زباله های رادیو اکتیو خاص، به خصوص محصول شکافت سزیم 137 که عمر طولانی دارد، انتخابی عمل می کنند. آنها برای جدا کردن این ایزوتوپ از سایر محصولات کم خطر شکافت به کار می روند.
غربالگران مولکولی دسته ی دیگری از مبدّل های یون غیر آلی هستند. این مواد آلومینوسیلیکات های کریستالی با ساختار های منظم و حاوی منافذی با اندازه های مشخص هستند که تنها یون های خاصی اجازه ورود به آن ها را دارند. هنگامی که آب از این منافذ حذف می شود، این مواد به جاذب های انتخابی مولکول های گازی با اندازه و شکل های خاص، تبدیل می شوند. آنها همچنین کاتالیزور های قدرتمندی هستند.
موادی که مبدل یون مایع نامیده می شوند، احتمالا باید برخلاف نامشان، به جای مبدّل های یون، در طبقه ی حلّال های آلی قرار گیرند. مولکول های این مواد حاوی زنجیره های هیدروکربنی طولانی هستند، که آنها را انحلال ناپذیر در آب می کنند، اما آنها همچنین شامل گروه های یونی هستند که یون هایی با بار مخالف را جذب می کنند. دینولین نفتالین سولفونیک اسید، (C9H19)2C10H5SO3H ، نمونه ای از مبدّل یون های مایع است.

